現在成長を遂げている産業のひとつが製薬産業。人類と病原菌の戦いは古くから、コロナ禍の現在まで続いており、新薬の開発を担う製薬産業は経済とも人命とも密接に関係しています。しかし、医療先進国であるはずの日本の製薬産業は元気がないようです。プロフェッショナルな投資家向けの講師として活躍する、国際政治アナリストの渡瀬裕哉氏に聞いてみました。
※本記事は、渡瀬裕哉:著『無駄(規制)をやめたらいいことだらけ——令和の大減税と規制緩和』(ワニブックス:刊)より一部を抜粋編集したものです。
日本の製薬産業はまだまだ成長する!
現代の成長産業のひとつに、製薬産業があります。人類と病原菌との闘いは歴史が古く、資料が残っているケースだけでも紀元前から存在しています。現代医学の劇的な進歩には、細菌感染を制御し、感染した際にはきちんと治癒させる技術が大いに貢献しています。大きな契機となったのは、1928年にイギリスのA・フレミングが発見したペニシリンの実用化です。

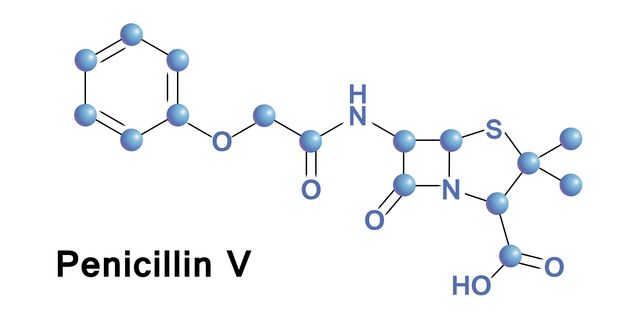
ペニシリンの臨床実験が成功したのは1941年のことで、第二次世界大戦で傷病兵の治療に用いられました。日本でも昭和19年(1944)に、陸軍軍医などによって開発に成功しています。
ペニシリンは、現在でも改良が続けられ、すぐれた細菌感染治療薬として使われています。その一方、ペニシリンが開発されたあとは、この特効薬でも治療できない感染症が判明していきます。ウイルス感染です。
科学や医学が発達した現在でも、ペニシリンに対する耐性を獲得した耐性菌や、これまでヒトへの感染例のなかったウイルス感染などが次々と現れ、人類と感染症との戦いは今後も続くと言われています。つまり、さまざまな感染症に対する治療薬の開発は今後、より一層重要になっていくとともに、新薬の開発を担う製薬産業は私たちの健康とも密接に関係している分野だと言えるのです。
既存の病気や症状、新しい感染症に対して、新しい薬の開発を担っているのが製薬企業です。新しい薬は、いくつものテストを経て、効果や安全性を厳しく検査されます。一定の検査基準をクリアすれば、実際に人体での投与と効果の確認を行い、正式に新薬として政府から承認を受けて市場に出ていくこととなります。政府からの承認を得るための試験過程を治験と言います。
2020年来の新型コロナウイルス感染症の世界的流行に際しては、この対応が各国政府の重要な課題となりました。ワクチンや治療薬の開発を政府が支援し、通常よりも優先的に承認して感染症の蔓延に対処しようとしたのです。
たとえばアメリカは、ドナルド・トランプ政権のもとで「オペレーション・ワープ・スピード」と呼ばれるワクチン計画を実施しました。既存の民間企業の研究や生産体制を基盤としながらも、170億ドル(約1兆8000億円)の資金投入、産官学の連携、手続きの簡素化により、通常は5年から10年かかると言われるワクチン開発を1年以内に実現する成果を上げています。
一般的に、新薬の開発には基礎研究から実際に市場に出るまで、10年ほどかかると言われています。さらに、海外ですでに販売されている医薬品のうち、日本では未承認となっている未承認薬の問題や、海外に比べて日本での発売までに時間がかかるといった問題もあります。
アメリカで医薬品の審査を行うのはFDA(アメリカ食品医薬品局)です。アメリカでFDAが承認した薬を日本国内でも流通させる場合は、厚生労働省の承認を受けるため、日本国内でも治験を行う必要があります。
同じ医薬品が市場に出るまで、他国に比べて長い時間がかかることを「ドラッグラグ」と言います。日本製薬工業協会によると、一昔前の2010年の時点の比較で、世界の市場に初めて登場した医薬品が、各国で承認発売されるまでの平均期間は、もっとも早いアメリカで0.9年、当時の日本は4.7年でした。
より効果のある医薬品による治療を待つ患者さんにとっては、この4.7年のタイムラグは非常に長いものです。医療先進国と言われる日本でも、当時は新しい医薬品の普及の面では世界で38位と決して良い環境ではなかったのです。
現在は、政府と審査機関が協力して、承認スピードを速めるための取り組みが行われています。国際共同治験への積極参加や、病院ごとに行われてきた臨床試験をネットワーク化することで、一度に多くの試験ができるようにするとか、審査員を増やすことによる審査の迅速化など、規制も緩和しながら効率的な審査・承認プロセスの整備を行っています。その結果、5年近くもあったドラッグラグは1年にまで短縮されました。


